Sanfter Reset: Körperzellen lassen sich leichter reprogrammieren als erwartet
Forschungsbericht (importiert) 2008 - Max-Planck-Institut für molekulare Biomedizin
Einleitung
Sie sind winzig und unscheinbar – und doch halten sie Forscher, Mediziner und Patienten seit einigen Jahren in Atem: Stammzellen aus menschlichen Embryonen sind zu einem der heißesten Objekte biomedizinischer Forschung avanciert. Denn dadurch, dass es US-Wissenschaftlern 1998 gelungen ist, diese Zellen im Labor zu züchten [1], hat ein alter Menschheitstraum neue Nahrung erhalten: Erstmals könnte es damit möglich werden, kranke und verletzte Gewebe durch Zugabe frischer, gesunder Zellen zu ersetzen und damit bislang unheilbare Krankheiten wie Parkinson oder Diabetes zu behandeln.
Noch ist offen, wann die ersten Therapien – wenn überhaupt – verfügbar werden. Schon jetzt aber steht fest: Der Coup des Teams um James Thomson von der University of Wisconsin ist ein Meilenstein der Biologie. Normalerweise finden sich embryonale Stammzellen (ES-Zellen) nämlich nur in einem sehr frühen Stadium der Entwicklung – dann, wenn fünf bis sechs Tage nach der Befruchtung einer Eizelle durch mehrere Teilungen ein kugelförmiges Gebilde aus 150 bis 200 Zellen entstanden ist. Die Stammzellen befinden sich im Inneren dieser Blastozyste und haben eine faszinierende Fähigkeit: Sie sind in der Lage, jeden der mehr als 200 verschiedenen Zelltypen des menschlichen Körpers mit allen seinen Organen und Gliedmaßen zu bilden.
Um mehr über die Multitalente zu erfahren, hatten Wissenschaftler schon früh versucht, menschliche ES-Zellen zu isolieren und im Labor zu züchten. Doch lange Zeit schlug jeder Versuch fehl. Denn Stammzellen sind extrem empfindlich. Es kommt nicht nur darauf an, dass die Embryonen, aus denen man sie gewinnt, intakt und lebensfähig sind. Ebenso wichtig ist, dass man weiß, mit welchen Nährstoffen sie in der Kulturschale versorgt werden müssen, damit sie gesund und am Leben bleiben. Mittlerweile ist die Züchtung menschlicher ES-Zellen freilich fast ein Routine-Verfahren. Heute gibt es weltweit mehr als 500 verschiedene Kulturen [2]. Und jedes Jahr kommen weitere Zell-Linien hinzu.
Multitalente mit Schattenseiten
All diese Kulturen haben allerdings einen entscheidenden Nachteil. Zwar lassen sich die Zellen im Prinzip unbegrenzt in der Kulturschale vermehren. Doch selbst wenn sie eines Tages zur Therapie bestimmter Krankheiten einsetzbar sein sollten, stehen Ärzte vor einem Problem, mit dem sie schon heute bei Organtransplantationen zu kämpfen haben: der Abstoßung von körperfremdem Gewebe. Um diese bedrohliche Immunreaktion zu verhindern, müssten die Behandelten lebenslang Medikamente einnehmen, welche die körpereigene Krankheitsabwehr schwächen. Das macht anfällig für Infektionen und erhöht das Krebsrisiko.
Warum aber, fragten sich viele Forscher seither, sollte es nicht möglich sein, die biologische Uhr zurückzudrehen? Zum Beispiel, indem man einige körpereigene Zellen des Patienten isoliert und im Labor wieder in einen ähnlichen Zustand versetzt, in dem sie sich ohnehin schon einmal befunden haben, als dieser noch ein Embryo war?
Allein der Gedanke an eine solche Möglichkeit schien noch bis vor wenigen Jahren absurd. Denn nach gängiger Lehrmeinung war die Sache ein klarer Fall: Sobald ein Mensch, ein Hund oder eine Maus geboren ist, gibt es für den Organismus kein Zurück. Ob Haut oder Haar, Fettgewebe oder Blut – keine spezialisierte Zelle des Körpers, so glaubte man, kann je wieder etwas anderes werden als sie ist.
Und sie verwandeln sich doch ...
Gleich mehrere Forscherteams haben dieses Dogma inzwischen widerlegt – darunter auch die Zellbiologen Jeong Beom Kim und Holm Zaehres vom Max-Planck-Institut für molekulare Biomedizin in Münster. Ihnen ist es als Ersten geglückt, Zellen erwachsener Mäuse mit lediglich zwei Faktoren in ihren embryonalen Zustand zurückzuversetzen und sie damit so umzuprogrammieren, dass sie jeden der mehr als 200 Zelltypen des Körpers bilden können (Abb. 1) [3].
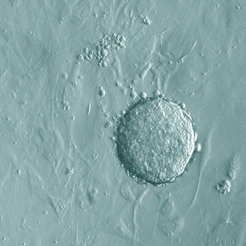
Damit konnten Kim und Zaehres nicht nur zeigen, dass die so genannte Reprogrammierung von Körperzellen unter bestimmten Bedingungen einfacher funktioniert als bisher angenommen. Vieles spricht auch dafür, dass die von ihnen entwickelte Methode die Risiken zukünftiger Stammzelltherapien für die Patienten deutlich reduzieren könnte.
Keine Frage: Den ersten entscheidenden Durchbruch auf dem Gebiet der Reprogrammierung hatten japanische Wissenschaftler vor zwei Jahren erzielt. Um die so genannten induzierten pluripotenten Stammzellen (iPS) zu erzeugen, hatte das Team um Shinya Yamanaka weder Eizellen noch Embryonen benötigt. Es genügte, vier Gene in das Erbgut der Hautzellen einzuschleusen: Oct4, Sox2, c-Myc und Klf4 [4]. Der Haken daran war nur: Viele der Tiere, denen man iPS-Zellen implantiert hatte, erkrankten wenige Wochen später an Krebs.
Aus vier mach zwei
Kim und Zaehres aus dem Team von Hans Schöler suchten daher nach Zellen, in deren Erbgut das eine oder andere der vier Reprogrammier-Gene natürlicherweise aktiv ist. Fündig wurden sie mit Zellen aus dem Hirn von Mäusen. In Untersuchungen an Zellen der Maus fanden sie heraus, dass so genannte neurale Stammzellen aus dem Gehirn von Natur aus erhöhte Mengen der Produkte von Sox2 und c-Myc bilden [3].
Neurale Stammzellen sind Vorläuferzellen, die zu verschiedenen Zelltypen des zentralen Nervensystems wie Neuronen, Astrozyten und Oligodendrozyten heranreifen können und die sich vergleichsweise leicht im Labor züchten lassen. Wie Kim und Zaehres nun zeigen konnten, reicht es für die Reprogrammierung dieser Stammzellen bereits aus, zwei der vier Gene aus dem Cocktail einzuschleusen: entweder Oct4 zusammen mit Klf4 oder aber Oct4 in Kombination mit c-Myc (Abb. 2).

Die Nutzung neuraler Stammzellen für spätere Therapien sei zwar unwahrscheinlich, räumen die Forscher ein. Denn die Zellen kommen vorwiegend im Gehirn vor. Sie lassen sich daher schlecht beim Menschen isolieren. Dank der neuen Erkenntnisse können Forscher jetzt aber gezielter nach Zelltypen im Körper suchen, die sich ähnlich gut eignen, aber leichter zugänglich sind.
Das Feintuning hat bereits begonnen
Zudem ist es mithilfe neuraler Stammzellen jetzt deutlich leichter, Wirkstoffe zu suchen, die die Reprogrammierung anstelle von Viren anschieben können. Solche kleinen, biologisch aktiven Verbindungen, im Fachjargon small molecules oder chemical compounds genannt, gelten als Hoffnungsträger der Stammzellforschung. Denn anders als beim Einschleusen von Genen lässt sich die Dauer und Stärke der Wirkung kleiner Moleküle viel genauer steuern: Sobald die Zellen erst einmal reprogrammiert sind, kann in ihnen das normale Entwicklungsprogramm ablaufen. Eingeschleuste Viren dagegen bleiben für immer im Erbgut – und können jederzeit aktiv werden und zum Beispiel Krebsgene aktivieren.
Die ersten, wichtigen Erfolge bei der Suche nach geeigneten Wirkstoffen konnte Schölers Team kürzlich bereits verbuchen [5; 6]. Gemeinsam mit Kollegen vom Scripps Research Institute im kalifornischen La Jolla haben die Forscher ein kleines chemisches Molekül entdeckt, mit dem sie in neuralen Stammzellen den Effekt eines eingeschleusten Oct4-Gens ersetzen können [5]. Und vieles spricht dafür, dass das auch bei den anderen Faktoren gelingen wird. Denn Oct4 hat eine Schlüsselrolle bei der Reprogrammierung. Nur kurze Zeit später zeigte dasselbe internationale Forscherteam, dass in Fibroblasten – für deren Reprogrammierung bislang vier Faktoren benötigt wurden – in Gegenwart von kleinen Molekülen nur noch zwei Faktoren genügten [6]. Diese Ergebnisse lassen die Forscher hoffen, dass in absehbarer Zeit auch die restlichen zwei Gene durch kleine Moleküle ersetzt werden können. Das würde die Chance eröffnen, nicht nur einige wenige, sondern alle Zellarten des Körpers für Stammzelltherapien zu nutzen.

