Proteinfaltung – auf das richtige Tempo kommt es an
Forschungsbericht (importiert) 2015 - Max-Planck-Institut für molekulare Biomedizin
Wie werden die Proteine einer Zelle hergestellt? Um die Frage zu beantworten, stellen Sie sich zunächst am besten die Fertigungsstraße einer modernen Autofabrik vor. Verschiedene Maschinen führen eine Vielzahl von Arbeitsschritten in einer festgelegten Reihenfolge und einem genau abgestimmten Rhythmus aus. Nur durch dieses perfekte Zusammenspiel entsteht am Ende ein fehlerfreies Auto, das auch nach vielen Jahren noch fährt. Ganz ähnlich funktioniert im menschlichen Körper die Herstellung der Proteine, der Arbeitstiere aller Zellen. Die sogenannten Ribosomen, große Komplexe aus Proteinen und Ribonukleinsäure (RNS), schweißen einzelne Aminosäuren zu Peptidketten zusammen (Abb. 1). Diese werden von speziellen Faltungshelfern, sogenannten Chaperonen, in die richtige Form gebracht. Was aber passiert, wenn diese Prozesse in Zellen aus dem Takt geraten? In einer Autofabrik ist die Antwort einfach: Liefe das Band langsamer, während die Maschinen im gleichen Tempo weiterarbeiten, säße die Schweißnaht am falschen Fleck und das Auto würde die abschließende Qualitätskontrolle nicht überstehen.
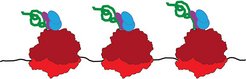
Abb. 1: Proteinherstellung – schematische Darstellung
Ribosomen (rot) lesen eine Boten-Ribonukleinsäure (schwarz). Die entstehende Aminosäurekette (grün) wird von Chaperonen (blau und violett) in die richtige Form gefaltet.
In Zellen fiel die Antwort schwer, und trieb Wissenschaftler aus dem Bereich der Protein-Qualitätskontrolle schon lange um. Es war klar, dass Chaperone entscheidend sind, damit Proteine ihre endgültige Form annehmen. Was aber passiert, wenn man die Produktionsgeschwindigkeit der Ribosomen stört? Auch wenn es zunächst so scheint, ist diese Frage nicht rein akademischer Natur. Wenn Proteine Qualitätsprobleme bekommen, klumpen sie zusammen und bilden Aggregate. Proteine, die sich in solchen Aggregaten befinden, können ihre Funktion nicht mehr erfüllen und mehr als das: Sie können sogar toxisch werden. Dass dies äußerst schlecht für unsere Zellen ist, sieht man daran, dass Proteinaggregate als Ursache oder Symptom verschiedener Degenerationserkrankungen gelten. Aber spielt es wirklich eine Rolle für die Funktion von Proteinen, wie schnell sie hergestellt werden? Die Antwort auf diese Frage kam wie so oft in der Forschung aus einer ganz anderen Richtung: der Qualitätskontrolle von Ribonukleinsäuren.
Die Schnörkel des genetischen Codes
In Lehrbüchern liest man oft, dass RNS-Moleküle die genetische Information in vier unterschiedlichen Bausteinen – sogenannten Nukleotiden – weitergeben. Das wird der natürlichen Komplexität vieler RNS-Moleküle aber nicht gerecht. Tatsächlich sind einzelne Nukleotide jedes RNS-Moleküls in der Zelle noch chemisch modifiziert (Abb. 2A) [1]. Die Modifikationen können zum Beispiel einfache Methylgruppen, aber auch komplexe chemische Gruppen sein (Abb. 2B).
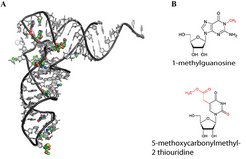
(A) Dreidimensionale Darstellung der Struktur einer Transfer-RNS. Kanonische Nukleotide sind in grau, chemische Modifikationen sind als farbige Kugeln dargestellt. (B) Zwei Beispiele für RNS-Modifikationen. 1-methylguanosin trägt eine einfache Methylgruppe. 5-methoxycarbonylmethyl-2-thiouridine gehört zu den komplexen Modifizierungen und trägt zwei unterschiedliche Modifikationen. Die chemischen Modifikationen sind jeweils rot dargestellt.
Man könnte sagen, dass der genetische Code „Schnörkel“ trägt. Und genau wie beim Lesen von Texten, wurden diese RNS-Schnörkel von vielen Wissenschaftlern ignoriert, weil unklar war, welche Funktion sie haben. Dabei sprach einiges dafür, dass die Modifikationen wichtig sind: Erstens findet man sie in allen Organismen. Zweitens befinden sich Modifikationen häufig in den Abschnitten der RNS-Moleküle, die für ihre Funktion wichtig sind. Schließlich wurde in den letzten Jahren bei mehreren Krankheiten entdeckt, dass die Modifizierungsenzyme mutiert sind. Dazu gehören neurodegenerative Erkrankungen, Krebs und Diabetes, um nur die wichtigsten zu nennen [2]. Ein guter Grund, genauer hinzuschauen. Und das hat die Max-Planck-Forschungsgruppe für RNA-Biologie dann auch getan.
Geschwindigkeitskontrolle bei der Proteinherstellung
Die Hypothese lautete, dass das Fehlen von Modifikationen die Geschwindigkeit der Proteinherstellung verändert. Doch wie lässt sich diese Vermutung testen? Bei Autos kann man sich an die Straße stellen und ihre Geschwindigkeit messen. Bei Ribosomen geht das nicht so einfach. Hier kam der technische Fortschritt in Form des sog. Ribosomen-Profilings den Forschern zur Hilfe (Abb. 3) [3].
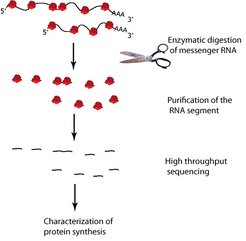
Ribosomen (rot) lesen Boten-RNS (schwarz). Durch enzymatischen Verdau wird die Boten RNS, die sich nicht in den Ribosomen befindet, verdaut. Die RNS-Schnipsel werden von den Ribosomen getrennt, sequenziert und charakterisiert.
Durch diese neue Methode lässt sich bestimmen, welche Proteine gerade von den Ribosomen einer Zelle hergestellt werden. Wirklich faszinierend ist aber, dass sich dabei viele Details des Lesevorgangs beschreiben lassen, unter anderem die Geschwindigkeit. Dazu liest man beim Ribosomen-Profiling mittels Hochdurchsatzsequenzierung alle RNS-Abschnitte, die gerade von Ribosomen in ein Protein übersetzt werden. Schaut man genug dieser Schnipsel an, kann man eine Aussage über alle Ribosomen einer Zelle treffen. Doch es dauert etwa drei Wochen, ehe die Wissenschaftler die vielen Millionen Sequenzschnipseln eines Experiments in ihrem Computer gespeichert haben. Und dann müssen die Sequenzen gelesen und interpretiert werden. Doch schlussendlich geben die Ribosomen ihre Geschwindigkeit preis, als ob die Experimentatoren Radarfallen in die Zellen gestellt hätten. Für die Experimente bieten sich Hefezellen an, denn sie sind einfach aufgebaut, bestehen aber aus denselben Bauteilen wie eine menschliche Zelle: Die Erbinformation wird im Zellkern aufbewahrt, Mitochondrien erzeugen Energie und Ribosomen sind die Fertigungsstraßen. Außerdem kann man auf einfache Weise Hefemutanten gewinnen, in denen Modifikationsenzyme defekt sind.
Wer bremst, verliert ...
Ein Blick auf die Daten zeigte sofort: Auch wenn die RNS nicht modifiziert ist, können Ribosomen die genetische Information grundsätzlich noch lesen. Nur die Abschnitte bzw. "Wörter", die RNS-Modifikationen benötigen, werden in Modifikationsmutanten deutlich langsamer gelesen als in normalen Hefezellen [4]. Die Genauigkeit des Lesens schien sich hingegen nicht zu ändern. Das war der erste direkte Hinweis darauf, dass Ribosomen tatsächlich langsamer lesen, wenn RNS-Modifikationen fehlen. Sofort wurde die Chance deutlich, die in diesen Mutanten lag: Bislang konnten Wissenschaftler nur die Gesamtgeschwindigkeit der Proteinherstellung mit Hemmstoffen verändern. An den Modifikationsmutanten ließ sich untersuchen, was passiert, wenn nur einzelne Abschnitte der Produktion gestört werden und der Rest scheinbar normal abläuft.
Was also passiert, wenn die Koordination der Ribosomen verloren geht? Die Zellen sind voll von Proteinaggregaten. Das war unerwartet, und daher war es wichtig, die Mechanismen anzuschauen, mit denen sich die Zelle davor schützt. Zellen versuchen aggregierte Proteine entweder durch Chaperone zu reparieren oder sie durch ihr Entsorgungssystem abzubauen. Die Experimente zeigten, dass beide Systeme massiv überfordert waren (Abb. 4A). Und so kann man die Proteinaggregate biochemisch aus den Zellen isolieren. Proteinaggregate sieht man nicht, wenn man die Normalgeschwindigkeit in den langsamen RNS-Abschnitten künstlich wiederherstellt. Es ist also wirklich die jeweilige Geschwindigkeit, die entscheidend ist. Gerät das Zusammenspiel zwischen der Herstellungsgeschwindigkeit der Proteine und der Faltung durch die Chaperone aus dem Gleichgewicht, entsteht ein Schaden. Es gilt hier: Wer bremst, verliert.
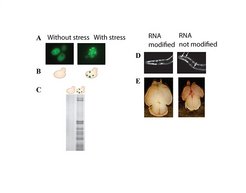
(A) Fluoreszenzaufnahme einer Hefe-Modifikationsmutante. Proteinaggregate sind durch ein Reporterprotein sichtbar gemacht. (B) Schematische Darstellung von (A). Proteinaggregate sind als rote Punkte, Reporterprotein als grüne Punkte dargestellt. (C) Biochemische Isolierung von Proteinaggregaten. Proteinaggregate aus Hefezellen sind erkennbar als dunkle Banden in einem Proteingel. Nur die Modifikationsmutante (rechts) enthält Aggregate, während normale Hefe (links) keine Aggregate enthält. Rechts: Morphologische Phänotypen in Mutanten für RNS-Modifizierungsenzyme (D) Fadenwürmer und (E) Mäuse. (D) Fadenwürmer in Fluoreszenzmikroskopie zeigen ein diffuses Proteinsignal. In Mutanten bilden sich Proteinaggregate (weiße Pfeile). (E) Gehirn einer Maus kurz nach der Geburt. Das Gehirn einer Mutante ist deutlich kleiner als normal (unten).
Ob Hefe, Würmer oder Mäuse – das Problem bleibt das gleiche
Als die Forscher nachschauten, welche Proteine sich in den Aggregaten befanden, kam die nächste Überraschung. Es sind nicht Proteine, die langsam gelesen werden, sondern solche, die instabil in der Zelle vorliegen. Auch im Normalfall braucht die Zelle wichtige Enzyme, die nur schwer löslich sind und daher schnell Aggregate bilden. Dadurch, dass die Lesegeschwindigkeit in den Mutanten aus dem Tritt gerät, kann die Qualitätssicherung der Zelle diese schwierigen Proteine nicht mehr reparieren und sie klumpen zusammen. Dadurch versagt die gesamte Zelle. Dies war ein ganz neuer Ansatz, um die Defekte von Modifikationsmutanten zu erklären.
Kann man aber von Hefe auf andere Organismen schließen? Eine wichtige Frage, wenn Aussagen über Krankheiten gemacht werden sollen. Eine Antwort erfolgte in zwei Schritten: Fadenwürmer lassen sich leicht untersuchen und besitzen ein Nervensystem. Ein Blick ins Mikroskop zeigte, dass Modifikationsmutanten Proteinaggregate enthalten und kürzer leben als normale Würmer (Abb. 4B) [4].
Doch funktionieren ähnliche Mechanismen auch in Wirbeltieren? Dieser Frage gingen die Wissenschaftler am Beispiel einer seltenen Erbkrankheit nach: Bei familiärer Dysautonomie ist ein Modifizierungsenzym defekt, was dazu führt, dass bei den Patienten ein Teil des Nervensystems nicht angelegt wird. Sie können daher kaum Sinnesreize wahrnehmen und sterben in relativ jungem Alter. Um zu untersuchen, ob es einen Zusammenhang zu den Ergebnissen in Hefen und Würmern gibt, arbeitete die Forschungsgruppe mit dem Labor von Laurent Nguyen zusammen [5]. Die belgischen Forscher hatten Mäuse, in deren Gehirn das Enzym nicht funktioniert. Auch hier stellte sich heraus, dass die Proteinherstellung verlangsamt und Proteinstress die Folge war. Dadurch kommen die Mäuse mit einem kleineren Gehirn zur Welt als ihre gesunden Geschwister (Abb. 4D). Ein scheinbar kleiner Effekt hat also schwerwiegende Konsequenzen.
Es zeigt sich, dass die Proteinherstellung ein komplexer Prozess ist, bei dem viele Faktoren eine Rolle spielen. Wie entscheidend die Geschwindigkeit ist, hat die Max-Planck-Forschungsgruppe für RNA-Biologie jetzt zeigen können, und man muss diesen Aspekt in Zukunft im Blick behalten. In der Vergangenheit haben Forscher in der Regel die Herstellungsgeschwindigkeit von Proteinen ignoriert und sich nur für deren Faltung und Abbau interessiert. Das muss sich nun ändern. Konsequenzen hat das Thema damit auch für die Biotechnologie. Die Herstellung von Proteinen, die in der Chemie- oder Pharmaindustrie verwendet werden, ist oft sehr schwierig und ineffizient. Ein genauer Blick auf die Herstellungsgeschwindigkeit mag auch hier Wunder wirken.



