Wie Leukozyten die Wand der Blutgefäße durchdringen
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für molekulare Biomedizin
Einleitung
Blutgefäße versorgen die Gewebe des Körpers mit Nahrungsstoffen und ermöglichen es Leukozyten, den Abwehrzellen des Immunsystems, im Organismus zu zirkulieren. Da das Blutvolumen nur ca. 5-7 Prozent des Körpervolumens ausmacht, ist es für die Bekämpfung von Infektionen entscheidend, dass Leukozyten in der Lage sind, aus dem Blut auszutreten und in infizierte Gewebe einzudringen (Abb. 1). Dieser Vorgang leitet Entzündungsreaktionen ein und hält sie in Gang und stellt damit sicher, dass Infektionserreger in den verschiedenen Geweben des Körpers überhaupt erst durch Leukozyten erreicht und bekämpft werden können. Auch andere Schädigungen des Körpers durch z. B. mechanische oder chemische Reize führen zur Auslösung von Entzündungen, Anlockung von Leukozyten und damit zur Einleitung des komplexen Vorgangs der Wundheilung.
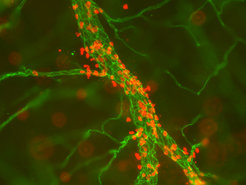
Dies sind die positiven Aspekte des Entzündungsprozesses, die sicherstellen, dass der Organismus Infektionen überlebt und verwundetes Gewebe zumindest in Teilen regenerieren und heilen kann. Die negative Seite des Entzündungsprozesses kommt zum Tragen, wenn die Abwehrreaktionen der Leukozyten sich durch pathologische Regulationsmechanismen gegen körpereigenes Gewebe richten (Autoimmunerkrankungen) oder wenn eine akute und durchaus notwendige, hilfreiche Entzündungsreaktion aus verschiedenen (oftmals nicht genau verstandenen) Gründen nicht wieder abklingt, sondern chronisch wird. In diesen Fällen kommt es zur Zerstörung von Gewebe und zu nur schwer behandelbaren Krankheiten wie rheumatoider Arthritis, Parodontose, multipler Sklerose, um nur einige wenige Beispiele zu nennen.
Es ist also von großer medizinischer Relevanz, die molekularen Grundlagen zu verstehen, die den Eintritt von Leukozyten aus dem Blut in die Gewebe kontrollieren. Aus den Forschungsarbeiten der letzten 20 Jahre ist bekannt, dass dieser Vorgang der Leukozyten-Extravasation in mehreren Schritten erfolgt. Durch das kontrollierte Zusammenspiel verschiedener Klassen von Zelladhäsionsmolekülen und chemo-attraktiver Signalstoffe werden Leukozyten in entzündeten Geweben aus dem Blutstrom abgefangen, was zur Anheftung an die Gefäßwand führt. Die innere Oberfläche der Gefäße wird durch eine Schicht von Endothelzellen ausgekleidet.
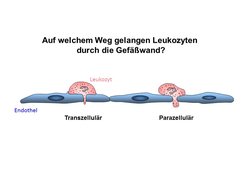
Während die meisten Adhäsionsmoleküle bekannt sind, über die Leukozyten an die Oberfläche von Endothelzellen binden, ist noch weitgehend ungeklärt, wie Leukozyten nach der Anheftung ans Endothel die Blutgefäßwand durchdringen, ein Prozess, der als Diapedese bezeichnet wird [1]. Prinzipiell scheinen Leukozyten den Endothelzellverband auf zwei sehr unterschiedlichen Wegen zu überwinden: zum einen durch die geöffneten Kontakte zwischen Endothelzellen (para-zellulär) und zum anderen sogar mitten durch den Körper von Endothelzellen hindurch (trans-zellulär) (Abb. 2).
Die Evidenz für beide Auswanderungsrouten basiert bisher auf elektronenmikroskopischen Analysen. Da es nur eine 3D-Analyse erlaubt, eindeutig zu bestimmen, über welche Route Leukozyten auswandern, sind serielle Schnitte für eine solche Analyse notwendig. Auf Grund der technischen Schwierigkeiten einer solchen Untersuchung haben sich bisher alle publizierten Arbeiten zu dieser Frage stets nur auf die Analyse von sehr wenigen Leukozyten beschränkt, was leider keine statistisch aussagekräftige Evaluation erlaubte. Deshalb wurde in der Abteilung von Dietmar Vestweber nun ein neuer technischer Ansatz zur Lösung dieser Fragestellung gewählt.
Das Verschließen von Endothelzellkontakten in Blutgefäßen der Maus blockiert die Einwanderung von Leukozyten in Gewebe
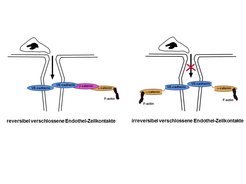
Durch einen molekulargenetischen Ansatz wurden genetisch veränderte Mäuse hergestellt, deren Endothelzellkontakte weitgehend verschlossen sind. Dies wurde dadurch erreicht, dass in diesen Mäusen das Hauptadhäsionsmolekül, das für den Zusammenhalt von Endothelzellkontakten verantwortlich ist, das VE-cadherin, so mutiert wurde, dass seine adhäsive Funktion nicht mehr abgeschaltet werden kann. Dazu wurde es kovalent mit dem intrazellulären Protein a-catenin verbunden, das normalerweise nur reversible Komplexe mit VE-cadherin bildet und damit die reversible Verankerung des VE-cadherin mit dem Zytoskelett vermittelt (Abb. 3). Da diese Verankerung von zentraler Wichtigkeit für die Adhäsionsfunktion von VE-cadherin ist, nahmen die Forscher an, dass die kovalente (also irreversible) Bindung von VE-cadherin mit a-catenin zum irreversiblen Verschluss der Kontakte zwischen Endothelzellen führen würde. In der Tat stellte sich heraus, dass die auf diese Weise genetisch modifizierten Mäuse in verschiedenen Testmodellen sehr deutlich stabilisierte Endothelzellkontakte aufwiesen. So zeigte sich, dass vasoaktive Substanzen wie Histamin, die zum Beispiel bei Insektenstichen die Permeabilität von Blutgefäßen drastisch erhöhen und dadurch zu Gewebsschwellungen führen, in den modifizierten Mäusen die Gefäßpermeabilität in der Haut nicht mehr beeinflussen konnten. Dies belegt, dass die Endothelzellkontakte in diesen Mäusen in der Tat irreversibel verschlossen sind [2].
Eine Analyse der Einwanderung von Leukozyten in verschiedene entzündete Gewebe ergab eine massive Reduktion in den genetisch modifizierten Mäusen im Vergleich zu normalen Mäusen [2]. Dies zeigt deutlich, dass der Weg durch Endothelzellkontakte der Hauptweg bei der Auswanderung von Leukozyten aus den Blutgefäßen und der Einwanderung in entzündete Gewebe ist. Interessanterweise wurde jedoch keinerlei Blockade der Einwanderung von naiven Lymphozyten in Lymphknoten festgestellt. Dieser Prozess läuft kontinuierlich ab und findet in dafür spezialisierten Blutgefäßen der Lymphknoten statt. Diese Ergebnisse legen den Schluss nahe, dass sich die Mechanismen der Leukozyten-Auswanderung in diesen spezialisierten Gefäßen von denen anderer Gefäße unterscheiden.
Ein Mechanismus, der die Öffnung endothelialer Zellkontakte einleitet
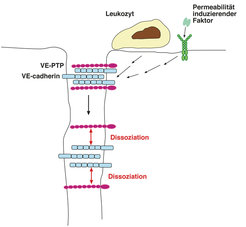
Auf der Suche nach einem Mechanismus, der die regulierte Öffnung endothelialer Zellkontakte auslöst, haben Wissenschaftler am MPI in Münster die Phosphatase VE-PTP an der Oberfläche von Endothelzellen gefunden. VE-PTP assoziiert spezifisch mit VE-cadherin und stabilisiert deutlich dessen Adhäsionsfunktion. Außerdem hat die Arbeitsgruppe gezeigt, dass Leukozyten, die an Endothelzellen binden, die Dissoziation der VE-PTP/VE-cadherin-Interaktion bewirken. Da der gleiche Effekt auch durch Permeabilität erhöhende Substanzen ausgelöst werden kann, wurde die Hypothese entwickelt, dass die Dissoziation von VE-PTP und VE-cadherin eine Voraussetzung zur Öffnung endothelialer Kontakte darstellt [3] (Abb. 4). Um dies zu beweisen, wurde wiederum ein molekulargenetischer Ansatz in der Maus gewählt. Es sollten genetisch modifizierte Mäuse generiert werden, bei denen durch Zugabe einer bestimmten Substanz gezielt die Dissoziation von VE-PTP und VE-cadherin verhindert werden kann. Falls die Dissoziation notwendig ist für die Öffnung endothelialer Zellkontakte, sollte die beschriebene Manipulation Leukozyten-Einwanderung in Gewebe und Permeabilitäts-Induktion inhibieren können. Um dies zu testen, wurden in einem molekulargenetischen Ansatz VE-cadherin und VE-PTP in Mäusen so mutiert, dass beide Proteine zusätzliche Bindungsstellen für einen niedermolekularen Wirkstoff erhielten, der die beiden Proteine irreversibel miteinander verbinden würde. Die intravaskuläre Verabreichung dieses Wirkstoffs an die auf diese Weise genetisch modifizierten Mäuse konnte in der Tat die Induktion vaskulärer Permeabilität sowie die Einwanderung von Leukozyten in entzündete Gewebe sehr deutlich inhibieren. Diese Ergebnisse belegen die Notwendigkeit der Dissoziaton des VE-PTP/VE-cadherin-Komplexes für die Öffnung endothelialer Zellkontakte in vivo [4].
Denkbare therapeutische Relevanz der Ergebnisse
Die Einwanderung von Leukozyten in entzündete Gewebe ist der zentrale Schritt, der Entzündungsprozesse in Gang hält. Die Blockade dieses Vorganges stellt einen direkten Weg dar, Entzündungen zu lindern oder zu unterbinden. Ein Paradebeispiel für das große Potenzial eines solchen therapeutischen Ansatzes ist die erfolgreiche Blockade von Adhäsionsmechanismen, die die Anheftung von Lymphozyten an das Endothel von Gefäßen des Zentralnervensystems (ZNS) vermitteln. Die Blockade dieses Mechanismus mit Hilfe spezifischer Antikörper stellt heute eine der erfolgreichsten Therapieansätze bei der Multiplen Sklerose dar, einer Krankheit des ZNS, bei der es zur Schädigung von neuronalen Strukturen des Gehirns durch eingewanderte Lymphozyten kommt. Auch in anderen chronischen Entzündungskrankheiten wie zum Beispiel der Psoriasis (Schuppenflechte) ist die Blockade von ähnlichen Adhäsionsmolekülen erfolgreich. Das Verständnis der molekularen Mechanismen der Leukozyten-Diapedese, also des Vorgangs des Hindurchwanderns durch die Gefäßwand, und dabei insbesondere die Aufklärung der Funktionsweise der Phosphatase VE-PTP könnte in der Zukunft zur Entwicklung neuer Therapieansätze zur Behandlung chronischer Entzündungen und pathologischer Permeabilitätserhöhung der Gefäße führen.



