Vom Ei zum Embryo: Die erste Weiche stellt der Zufall
Forschungsbericht (importiert) 2007 - Max-Planck-Institut für molekulare Biomedizin
Einleitung
Der Start ins Leben eines Menschen beginnt mit einer Verschmelzung: Kurz nachdem ein Spermium in eine reife Eizelle eingedrungen ist, treffen die Chromosomen von Ei- und Samenzelle aufeinander. Etwa 30 Stunden danach teilt sich die befruchtete Eizelle zum ersten Mal – ein Vorgang, der sich von nun an etwa alle 20 Stunden wiederholt. Aus zwei werden vier, acht und schließlich 16 Zellen (Abb. 1). Noch ist die Zellkugel gegenüber der Eizelle, die gerade einmal einen Zehntelmillimeter misst, kaum gewachsen. Doch drei bis vier Tage nach der Befruchtung erreicht der Embryo die Gebärmutter: Ein Flüssigkeitsstrom sowie Härchen im Eileiter haben ihn dorthin befördert.

In diesem Stadium kommt Bewegung in die Kugel: Flüssigkeit dringt in ihr Inneres und drückt die Embryo-Zellen auseinander. Der Embryo heißt nun Blastozyste und besteht schon aus etwa 64 Zellen. Sie werden flacher und kompakter und bilden schließlich eine Hohlkugel aus zwei Zellschichten: dem äußeren Trophoblasten und dem inneren Embryoblasten. Damit hat sich im Embryo die erste entscheidende Weichenstellung vollzogen. Zumindest grob sind jetzt schon die Aufgaben unter den Zellen verteilt [1]: aus dem Trophoblasten wird die äußere Embryonalhülle und später ein Teil des Mutterkuchens (Plazenta), der den Keim umgibt und ihn mit Sauerstoff und Nährstoffen versorgt, und aus einem Teil der inneren Zellen, von denen sich embryonale Stammzellen ableiten lassen, entwickelt sich das Kind. Diese Zellen verfügen über eine faszinierende Eigenschaft namens Pluripotenz – die Fähigkeit, jeden der mehr als 200 verschiedenen Zelltypen des Körpers zu bilden.
Nach etwa fünf Tagen besteht die Blastozyste aus gut 100 Zellen. Um weiter wachsen und gedeihen zu können, muss sie sich in der Gebärmutter, dem Uterus, einnisten und Kontakt mit dem Blutkreislauf der Mutter aufnehmen. Dazu sondern die Trophoblast-Zellen Enzyme ab, die einige Zellen in der obersten Schicht der Gebärmutterschleimhaut auflösen. Der Embryo kann sich nun in das Bindegewebe der Schleimhaut schieben. Über ihm wachsen neue Hautzellen und schließen die „Wunde“.
Während dieses Einnistens nimmt der Embryo Proteine, Zucker, Fette und Reste der zerstörten Schleimhaut auf. Das hat Folgen: Sein Durchmesser wächst auf mehr als das Doppelte. Im Trophoblasten entstehen kleine, mit Blut gefüllte Hohlräume (Lakunen). Schließlich lösen die Zellen des Trophoblasten die mütterlichen Blutgefäße in der Gebärmutterschleimhaut teilweise auf. Am Ende der zweiten Woche kann daraufhin mütterliches Blut in die Lakunen einströmen und sie durch kleine Blutgefäße wieder verlassen. Auf diese Weise wird der Embryo von nun an rund neun Monate lang von der Mutter mit allen lebensnotwendigen Ressourcen versorgt.
Die entscheidende Schicht
Was so ausgeklügelt und perfekt abgestimmt klingt, ist tatsächlich eine Meisterleistung der Evolution. Eine maßgebliche Rolle spielt dabei der Trophoblast, eine Struktur, die nur bei höheren Säugetieren vorkommt und deshalb auch ein Schlüsselmerkmal dieser Tierklasse ist. Diese Zellschicht ermöglicht nicht nur die Einnistung des Embryos in die Gebärmutter. Die Plazenta, die daraus hervorgeht, bildet auch eine immunologische Barriere und erlaubt dadurch ein langes Heranwachsen der Nachkommen im Mutterleib.
Doch wie entstehen die ersten Unterschiede zwischen den Zellen? Woher wissen sie, welche von ihnen nach innen wandern und den Organismus und welche die Plazenta bilden sollen? Genau diesen Fragen gehen die Forscher der Nachwuchsgruppe von Takashi Hiiragi in Untersuchungen an befruchteten Eizellen von Mäusen auf den Grund. Auf den ersten Blick haben die Nager mit dem Menschen zwar nicht allzu viel gemein. Dennoch ähneln sich ihre Gene, Organe und Zellen so weit, dass sich viele der daraus gewonnenen Erkenntnisse zumindest teilweise auch auf den Menschen übertragen lassen.
Um den Antworten auf ihre Fragen auf die Spur zu kommen, haben Hiiragi und Jens-Erik Dietrich in zahlreichen Experimenten analysiert, wann die ersten Unterschiede zwischen den Zellen im frühen Maus-Embryo auftauchen. Zunächst haben die Wissenschaftler dazu die Eigenschaften und die Position der einzelnen Zellen im frühen Embryo im Verlauf der Zellteilungen verfolgt.
Die Menge macht’s
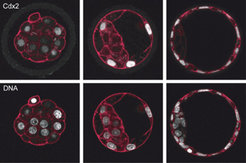
Dazu untersuchten Hiiragi und Dietrich, in welchen Mengenverhältnissen drei Proteine namens Oct4, Cdx2 und Nanog in den einzelnen Zellen vorliegen. Alle drei Faktoren sind als wichtige Regulatoren der Embryonalentwicklung bekannt [2-4]. Zudem wusste man bereits, dass die Proteine im 8-Zell-Stadium, wenn sich die befruchtete Eizelle drei Mal geteilt hat, noch in allen Zellen zu finden sind [1]. Schon wenige Teilungen später, wenn die Blastozyste bereits aus 64 bis 128 Zellen besteht und zwei klar unterscheidbare Zellschichten ausgebildet hat, sind die Eiweiße jedoch nur noch in der inneren Zellmasse (Oct4 und Nanog), oder aber ausschließlich in den äußeren Zellen (Cdx2), dem Trophoblasten, zu finden. Diesen markanten Unterschied machten sich die Forscher zunutze, um die molekularen Mechanismen aufzuklären, die das Schicksal der Zellen im Embryo in den ersten Lebenstagen festlegen (Abb. 2).
In einem ihrer Experimente isolierten die Max-Planck-Forscher dazu einzelne Zellen aus Mausembryonen, die sich gerade im 8-Zell-Stadium befanden [5, 6]. Anschließend brachten die Forscher die isolierten Zellen in der Kulturschale dazu, sich ein oder zwei weitere Male zu teilen. Aus einigen der Zellen gingen zwei gleich große Tochterzellen hervor. Sie hatten sich also symmetrisch geteilt. Die anderen Zellen dagegen hatten sich asymmetrisch geteilt und zwei unterschiedlich große Tochterzellen gebildet.
Ungleiche Töchter
Welcher Mechanismus darüber entscheidet, ob sich eine Zelle symmetrisch oder asymmetrisch teilt, ist unklar. Fest steht jedoch, dass mit der asymmetrischen Teilung im Inneren der Zellen eine entscheidende biochemische Veränderung eintritt [5]. Wie die Proteinanalysen der Forscher zeigten, enthielten zwar Tochterzellen – ob symmetrisch oder asymmetrisch geteilt – in etwa dieselbe Menge an Nanog. Bei den in den Zellen enthaltenen Mengen an Cdx2 zeigte sich jedoch ein deutlicher Unterschied: Wenn sich eine Zelle asymmetrisch geteilt hatte, fand sich in der größeren Tochterzelle stets eine höhere Konzentration an Cdx2 als in der kleineren [6].
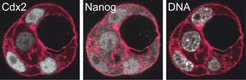
Zudem bildeten die Zellen, nachdem sie sich zwei Mal in der Kulturschale geteilt hatten, Mini-Blastozysten aus vier Zellen. Die Zellen, die außen lagen, wiesen dabei stets mehr Cdx2 auf als die inneren (Abb. 3). Die Forscher schließen aus dieser Beobachtung, dass zunächst die Art der Zellteilung darüber entscheidet, wie hoch die Cdx2-Konzentation in den Zellen ist. Das Proteinmuster, das sich daraus ergibt, bestimmt anschließend darüber, ob sich die Zelle ins Innere oder aber an die äußere Oberfläche der wachsenden Blastozysten-Kugel bewegt.
Erstaunlicherweise, so stellten die Forscher fest, ist die Anzahl der Zellen eines Embryos, die eine asymmetrische Teilung durchlaufen, sehr variabel. Offenbar, so vermuten die Forscher, ist diese Variabilität in der Art der Zellteilung für die Bildung der Blastozyste unerheblich. Die Prozesse, die die Proteinmuster in den Zellen bestimmen, sind in ihrer Regulation demnach enorm flexibel.
Der Zufall stellt die Weichen
Hiiragis und Dietrichs Befunde widerlegen damit eine von etlichen Wissenschaftlern gehegte Annahme, dass in jeder Eizelle bereits zum Zeitpunkt ihrer Befruchtung eine Teilungsachse und damit auch alle weiteren Teilungsschritte in ihrer Geometrie festgelegt sind [7]. Die jüngsten Ergebnisse sprechen nach Ansicht der Münsteraner Forscher vielmehr dafür, dass die Zellen des frühen Embryos ihr jeweiliges „molekulares Profil“ nach dem Zufallsprinzip erhalten [8].
Tatsächlich ist es damit der Zufall, der die Weichen für die gesamte weitere Entwicklung stellt. Erst sind die Konzentrationsunterschiede der maßgeblichen Proteine noch gering, bald werden sie immer größer, bis am Ende eine klare Polarität entsteht: Jene Zellen, die im Laufe der Blastozystenbildung nach außen driften, entwickeln sich zum Trophoblasten, der ein Teil der Plazenta wird und nach der Geburt mit ihr untergeht [6]. Sehr interessant sind auch die embryonalen Stammzellen, die sich aus dem Inneren der Blastozyste ableiten lassen.
Seit langem weiß man, dass aus jeder dieser Stammzellen jeder der mehr als 200 verschiedenen Zelltypen des Körpers hervorgehen kann. Noch ist allerdings weitgehend ungeklärt, auf welchen molekularen Faktoren diese so genannte Pluripotenz beruht. Das herauszufinden, ist jedoch nicht nur für Grundlagenforscher interessant. Würde es zum Beispiel gelingen, ausgereifte Körperzellen wieder gezielt in solche Alleskönner zu verwandeln, böten sich auch enorme Chancen für die Medizin. Erstmals könnte es dann möglich werden, bislang unheilbare Krankheiten wie Parkinson oder Diabetes mithilfe patienteneigener, gesunder Ersatzzellen zu behandeln.
Zell-Klau mit unklaren Folgen
Möglicherweise geben die Untersuchungen der Münsteraner Max-Planck-Forscher aber bald auch noch Antworten auf eine ganz andere Frage. In vielen Ländern nehmen Reproduktionsmediziner seit Jahren im Rahmen der künstlichen Befruchtung genetische Tests an Embryonen vor. Bei dieser so genannten Präimplantationsdiagnostik (PID), die in Deutschland verboten ist, wird dem wenige Tage alten Embryo im Labor eine einzelne Zelle für die Gen-Analyse entnommen. Ergibt der Test einen ungünstigen Befund, wird der Keimling nicht in die Gebärmutter der Frau eingesetzt und man lässt ihn absterben. Finden sich im Erbgut des Embryos keine Defekte, wird er in den Uterus eingesetzt. Bisher geht man davon aus, dass der Zell-Klau dem Embryo in der Regel nicht schadet. Denn inzwischen wurden schon etliche PID-Kinder geboren. Sicher wissen kann es bisher jedoch niemand. Denn verlässliche Statistiken über Fehlgeburten und fehlgeschlagene In-vitro-Fertilisationen gibt es bislang nicht [9].
Fraglich ist zudem, wie es um jene Zelle steht, die für den Gentest entnommen und zur Analyse zwangsläufig zerstört werden muss: Bisher nämlich kann niemand wissen, ab welchem Teilungsschritt die einzelnen Zellen des Embryos ihre Totipotenz verlieren [9]. Darunter versteht man die Fähigkeit, in geeigneter Umgebung zu einem kompletten Individuum heranwachsen zu können.
Mehrere Untersuchungen deuten darauf hin, dass jede der vier oder acht Zellen, die nach der zweiten und dritten Teilung entstanden sind, noch totipotent ist [8, 10]. Weitere Untersuchungen wie jene von Hiiragi und Dietrich werden jedoch zeigen müssen, ab wann das Schicksal der Zellen endgültig festgelegt ist.


