Genexpression und Funktion der Gene in der Keimbahn der Maus
Forschungsbericht (importiert) 2003 - Max-Planck-Institut für molekulare Biomedizin
Einleitung
Die theoretische und experimentelle Unterscheidung von "Körper" (Soma) und "Keim" hat Wissenschaftler seit Anbeginn der Embryologie fasziniert. Eine Theorie, die 1885 von August Weismann vorgestellt wurde, besagt, dass der Keim in Organismen durch ein Plasma mit spezifischen Determinanten bestimmt wird. Gemäß dieser Theorie können die Körper von Metazoen als vergängliche Transportsysteme für die zur Fortpflanzung notwendigen Keime betrachtet werden. Die Fusion von Eizelle und Spermium führt zur Bildung eines neuen Keimes, der nach kurzer Zeit sowohl Körper als auch Keimzellen hervorbringt. Der Körper nährt und schützt die Keimzellen, während diese sich in spezialisierte Gameten entwickeln, die nach Fusion beider Typen von Gameten wieder einen neuen Keim bilden, und der Lebenszyklus startet erneut.
Determinanten der Keimbahn
Drosophila, C.elegans und die Maus: Im Tierreich scheinen in Eizellen vorhandene Determinanten ein weit verbreitetes System für die Festlegungen von Keimzellen zu sein, wie die "P-Granules" von C. elegans oder die "Polar Granules" von Drosophila. In Säugern jedoch konnten solche Determinanten nicht nachgewiesen werden und es ist fraglich, ob sie überhaupt Determinanten besitzen, die denen von C. elegans oder Drosophila entsprechen. Während Determinanten bereits sichtbar in Eizellen dieser Spezies vorliegen und eine sehr frühe Trennung von Körper- und Keimzellen zu beobachten ist, findet eine Aufspaltung von Körper und Keimzellen bei Säugern erst während der Bildung der Keimblätter (Gastrulation) statt. Auch scheinen diese Zellen des Säugerembryos vor der Gastrulation noch nicht in ihrem Differenzierungspotenzial eingeschränkt. Im Mausembryo werden etwa 6.5 Tage nach der Befruchtung in dem proximalen Bereich des embryonalen Zylinders Keimzellen induziert, wobei Signale aus dem extraembryonalen Ektoderm eine wichtige Rolle spielen. Während dieser Spezifikationsphase können die Vorläuferzellen neben Urkeimzellen noch in somatische Zelltypen differenzieren, wie etwa extraembryonales Mesoderm und Allantois (Urharnsack). Werden Zellen des Mausembryos noch vor der Gastrulation in den proximalen Bereich des embryonalen Zylinders transplantiert, so können sie gemäß ihrem neuen Ort zu Urkeimzellen differenzieren, obwohl sie am ursprünglichen Ort einen anderen Zelltyp gebildet hätten.
Keimbahn der Säuger und Pluripotenz
Pluripotenz im Säugerembryo: Befunde dieser Art legen nahe, dass die Keimbahn von Säugern in zwei Phasen unterteilt werden kann. In der ersten Phase, die bis etwa zur Gastrulation dauert, sind die Zellen der Keimbahn noch nicht festgelegt und können entsprechend ihrer Position im Embryo unterschiedliche Zelltypen des Körpers oder Keimzellen bilden. Die Fähigkeit von Zellen nahezu alle Zelltypen hervorbringen zu können, wird als Pluripotenz bezeichnet. Der Phase pluripotenter Zellen der Keimbahn folgt die Phase unipotenter Zellen. In dieser zweiten Phase sind die Zellen der Keimbahn festgelegt und als Keimzellen identifizierbar.
Pluripotenz in der Kulturschale: Während pluripotente Zellen im Embryo nur während einer begrenzten Periode auftreten, kann man aber pluripotente Zellen einiger Säuger dauerhaft in Kultur nehmen und durch entsprechende Bedingungen die Differenzierung in Körperzellen verhindern. Dies ist zuerst bei der Maus, später bei bestimmten Affen und auch beim Menschen gelungen. Leitet man Zelllinien von pluripotenten Zellen in frühen Embryonen, so genannten Blastozysten ab, werden sie embryonale Stammzellen (ES-Zellen) genannt. ES-Zellen sind das Ergebnis einer kulturbedingten Transformation pluripotenter Zellen des Embryos und daher nicht mit ihnen gleichzusetzen. Der wichtigste Unterschied ist der, dass - im Gegensatz zu den nur kurzzeitig im Embryo vorkommenden pluripotenten Zellen - ES-Zellen bei sachgemäßer Behandlung in Kultur nahezu unbegrenzt vermehrt werden können. Es gibt aber wesentliche Eigenschaften, die beibehalten werden. Dies ist zum einen, dass ES-Zellen auch in Kultur pluripotent sind, da sie je nach Bedingung in unterschiedliche Zelltypen des Körpers differenziert werden können. Zum anderen können sie sich, wenn sie in Blastozysten injiziert werden, in den Verband pluripotenter Zellen des Embryos einfügen und alle Zelltypen des Körpers, aber auch Keimzellen bilden. Interessanterweise lassen sich Urkeimzellen, (prämigratorische und frühe migratorisiche Keimzellen) durch geeignete Kulturbedingungen ebenfalls zu Zellen transformieren, die ES-Zellen ähneln. Wegen ihrer unterschiedlichen Herkunft werden sie EG-Zellen (embryonale Keimzellen, engl. Embryonic Germ Cells) genannt.
Das Oct4-Gen als Markierungshilfsmittel für die Keimbahn von Säugern
Expression: Oct4 ist das einzig bekannte Gen, das spezifisch in der Keimbahn von der Maus exprimiert wird.
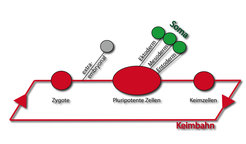
Oct4-Transkripte und Protein findet man bereits in der Eizelle, nicht aber im Spermium. Nach der Befruchtung nimmt die Menge an RNA und Protein bis zum Vierzell-Stadium ab, danach beginnt die zygotische Expression des Oct4-Gens. Während der weiteren Entwicklung des frühen Mausembryos wird Oct4 in den pluripotenten Zellen des Embryos exprimiert. Mit der Abnahme an Genaktivität geht auch der Verlust an Pluripotenz einher. Das erste Mal, dass eine Abnahme stattfindet, ist in den äußeren Blastomeren der Morula. Das sind diejenigen Zellen des Embryos, die in trophektodermale Zellen differenzieren. Die inneren Zellen, die den Epiblast (auch Embryonalknoten, primitives oder embryonales Ektoderm genannt) bilden, exprimieren Oct4 bis zur Gastrulation. Nur in den Zellen des zur gleichen Zeit entstehenden Hypoblasten (auch primitives oder embryonales Entoderm genannt) nimmt die Oct4-Genaktivität ab. Nach der Gastrulation findet man Oct4 ausschließlich in Keimzellen. Allerdings findet man Oct4 nicht durchgängig während der Keimzelldifferenzierung, da dessen Aktivität noch vor der Meiose der männlichen und weiblichen Keimzellen abnimmt. Oct4 wird zu Beginn der meiotischen Prophase I (13-14 Tage nach der Befruchtung) in der Maus reprimiert. Das Oct4-Gen wird während der Oogenese wieder aktiv, wohingegen es während der Spermatogenese nicht wieder angeschaltet wird. In den Oozyten wachsender Follikel findet man direkt nach der Geburt Oct4-Transkripte und Protein und zwar unabhängig vom Reifungsgrad der Follikel.
POU-Familie: Das Oct4-Protein ist Mitglied der POU-Familie von Transkriptionsfaktoren. Diese Familie ist dafür bekannt, dass sie eine Vielzahl von biologischen Prozessen regulieren. Das große Spektrum an Aktivitäten steht aber in krassem Gegensatz zu der kleinen Zahl an Genen, die die Familie ausmachen. So findet man nur 15 POU-Gene im humanen Genom, fünf im Genom von Drosophila und vier in dem von C. elegans. Es wurde beschrieben, dass Oct4 seine Funktion molekular auf unterschiedliche Art ausübt. Eine Möglichkeit, mit der Oct4 sein Spektrum an Aktivitäten erweitert, ist durch Interaktion mit anderen Transkriptions- und Kofaktoren. Die in Wechselwirkung tretenden Proteine können Mitglieder derselben Familie sein oder Mitglieder anderer Familien. So dienen bestimmte Proteinoberflächen als Plattform für die Interaktionen mit Transkriptionsfaktoren unterschiedlicher Familien, wobei zum Teil dieselben Aminosäuren für die jeweiligen Wechselwirkungen verwendet werden. So kann Oct4 beispielsweise mittels einer Oberfläche mit Oct1, Oct6 oder einem zweiten Oct4 interagieren, aber auch mit Sox2. Die Oberfläche von Sox2 wiederum, die an Oct4 bindet, kann mit Mitgliedern einer dritten Familie von Transkriptionsfaktoren, den PAX-Proteinen, interagieren. Die Bedeutung der einzelnen Wechselwirkungen im Kontext der Zelle und dem sich entwickelnden Organismus muss allerdings noch belegt werden.
Funktion: In einer Reihe von Säugern, wie auch beim Menschen, wurden Gene identifiziert, die Orthologe zu dem Oct4 der Maus darstellen, so auch beim Menschen. Dagegen besitzen beispielsweise weder Drosophila noch C. elegans ein Oct4-Gen. Die Rolle des POU-Domänen-Transkriptionsfaktors Oct4 in der Keimbahn der Maus ist essentiell, dessen Verlust hat je nach Entwicklungsstadium unterschiedliche Auswirkungen. Fehlt die Funktion sehr früh in der Embryonalentwicklung, dann entstehen im Embryo nicht pluripotente Zellen, sondern stattdessen trophektodermale Zellen. Somit weichen die Zellen der Keimbahn auf die früheste Nicht-Keimbahnlinie während der Entwicklung aus. Wie wir kürzlich nachweisen konnten, führt das Fehlen von Oct4 in der zweiten Phase zum Zelltod (Apoptose) von Urkeimzellen. Somit wird Oct4 in der ersten Phase der Keimbahn zur Aufrechterhaltung der Pluripotenz embryonaler Zellen benötigt, in der zweiten zum Überleben der Keimzellen.
Regulatorische Elemente: Oct4 übt nicht nur unterschiedliche Funktionen in der frühen und späten Phase der Keimbahn aus, sondern es werden auch unterschiedliche regulatorische Elemente im 5’ Bereich des Promoters verwendet, um die Expression des Gens zu gewährleisten. Diese Elemente konnten zuerst durch eine grobe Deletionsanalyse bestimmt werden, später im Detail durch den Sequenzvergleich verschiedener Oct4-Gene. Dazu wurde das Oct4-Gen des Menschen mit den orthologen Genen der Maus und des Rindes verglichen. So ergab die Grobkartierung, dass das proximale Element für die Expression in pluripotenten Zellen wichtig ist, das distale Element für die Expression in Keimzellen. Der Sequenzvergleich ermöglichte es den Wissenschaftlern in Münster, die Grenzen zwischen Elementen für die Expression in pluripotenten Zellen und in Keimzellen präziser zu definieren und dadurch die Aktivität noch besser voneinander zu trennen. So enthält nun das proximale Element zwei Regionen, die in den unterschiedlichen Säugern konserviert sind (CR2 und CR3), das distale Element eine konservierte Region (CR4).
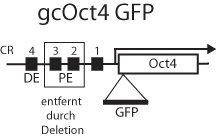
CR2 und CR3 besitzen zum Teil dieselben DNA- Bindungsstellen für Transkriptionsfaktoren. Durch Deletion der Region mit dem distalen Element generierten Schöler und sein Team genomische Fragmente, die nur in den pluripotenten Zellen der Maus aktiv sind, durch Deletion des proximalen Elementes solche, die während der Mausentwicklung in frühen Keimzellstadien, nicht aber in pluripotenten Zellen aktiv sind.
Etablierung eines keimzellspezifischen In-vitro-Differenzierungssystems
Das keimzellspezifische Transgen gcOct4-GFP: Das Konzept der positionsabhängigen Differenzierung pluripotenter Zellen hat die Forscher veranlasst, nach Bedingungen zu suchen, um in der Kulturschale Keimzellen aus embryonalen Stammzellen zu gewinnen. Bis zu dem Zeitpunkt war es zwar möglich gewesen, Abkömmlinge der drei Keimblätter von ES-Zellen abzuleiten, Keimzellen konnten aber nicht identifiziert werden. Eine wichtige Vorraussetzung ES-Zellen zu differenzieren war es, Keimzellen lebend nachweisen zu können. Dies bewerkstelligten Schöler und seine Leute, indem sie das keimzellspezifische Transgen mit einer cDNA für ein grün fluoreszierendes Protein (GFP) verknüpften. Die Spezifität des Oct4 GFP-Transgens (gcOct4-GFP) wurde getestet, indem aus transformierten ES-Zellen nach Injektion in Blastozysten transgene Mäuse generiert wurden. Diejenigen ES-Zellen wurden für die Untersuchungen in der Kulturschale eingesetzt, die in transgenen Mäusen Keimzellen, nicht aber Epiblastenzellen grün färbten. Die grüne Markierung erlaubte es zum einen, geeignete Bedingungen für die Bildung von Keimzellen aus ES-Zellen zu etablieren, zum anderen die unterschiedlichen Keimzellstadien während der Embryogenese zu verfolgen. Das gcOct4-GFP-Transgen diente dabei lediglich zur Festlegung der Bedingungen. Nachdem diese einmal etabliert wurden, wurden sie mit ES-Zellen reproduziert, die kein Transgen besaßen. Zusammengefasst bestehen die Bedingungen darin, dass ES-Zellen ohne Nährzellen auf unbeschichtete Kulturschalen dicht ausplattiert werden. Es bilden sich innerhalb weniger Tage Kolonien, in deren Zentren sich grüne Keimzellkolonien befinden.
Oct4 und Vasa: Während der Mausentwicklung nimmt die Aktivität des Oct4-Gens noch vor der Meiose sowohl der weiblichen als auch der männlichen Keimzellen ab. Die Meiose beginnt, nachdem sich die Keimzellen - nach ihrer Wanderung durch den sich entwickelnden Embryo - bereits etwa zwei Tage in den Keimleisten befinden. Eine Identifikation von Keimzellen aus ES-Zellen in der Kulturschale ohne den Verbund mit somatischen Zellen der Gonade und ohne GFP-Markierung war nicht möglich und machte die Verwendung weiterer spezifischer Gene notwendig. Als besonders geeignet für die Untersuchungen stellte sich das Vasa-Gen heraus. Das Vasa-Protein wird erstmals in postmigratorischen Keimzellen gebildet und ist auch in späteren Keimzellstadien nachweisbar. In dem Schema von Hans Schöler entsprechen grüne Zellen, die kein Vasa bilden, Urkeimzellen vor Erreichen der Keimleisten. Bei denjenigen Zellen, die sowohl Oct4 als auch Vasa exprimieren, handelt es sich um frühe postmigratorische Keimzellen bis etwa zu Beginn der Meiose. Danach können Keimzellen nicht mehr durch GFP, sondern nur noch durch Vasa identifiziert werden.
Oct4 und der Oberflächenrezeptor c-kit zur Identifikation von Urkeimzellen: Durch Verwendung von Antikörper gegen c-kit lässt sich in Kombination mit GFP eine Population von Zellen sortieren, die sehr frühen Keimzellen entspricht. Diese Population besitzt weder Marker für Vasa noch für meiotische Gene. Während der Mausentwicklung besitzt jeder Embryo zu diesem frühen Zeitpunkt etwa 100 Zellen. Daher eignen sich die in Kultur gewonnenen Keimzellen besonders gut für solche Versuche, die nicht mit kleinen Zellzahlen auskommen, wie bestimmte biochemische oder zellbiologische Ansätze. Der Gruppe in Münster soll dieses System dazu dienen zu bestimmen, welches genetische Programm in frühen Keimzellen etabliert wird.
Die Bildung von Follikeln: Nachdem die Keimzellen in vivo die Keimleisten erreicht und kolonisiert haben, ändern sie ihre Morphologie drastisch. Während der Wanderung durch den Embryo bilden Keimzellen nämlich Filopodien und Lamellipodien aus und berühren einander über dentritsche Fortsätze. In den Keimleisten angelangt, runden sie sich dagegen ab. Das Zurückziehen von den anderen Keimzellen ist notwendig, damit Keimzellen Kontakte mit anderen Zellen eingehen können. Im Falle der weiblichen Keimbahn bilden somatische Zellen und Keimzellen Aggregate, die Primordialfollikel genannt werden. Die an der Keimzelle gelagerten somatischen Zellen differenzieren zu Granulosazellen, die eine wichtige Rolle bei der Entwicklung der Eizelle aus der ursprünglichen Keimzelle des Follikels, der Oogonie, haben. In der Kulturschale gibt es zwar auch Hinweise auf Wanderung, allerdings trifft dies nicht auf die Mehrzahl der Zellen zu. Die Keimzellen bilden oftmals Kolonien von mehreren hundert Zellen. Interessanterweise runden sich die Keimzellen in diesen Kolonien ebenfalls ab und wie im Embryo geht dies mit der Expression von Vasa einher. Da diese Kolonien nur aus Keimzellen bestehen, können sie nicht innerhalb einer Kolonie mit somatischen Zellen in Kontakt treten. Dies geschieht in Kultur auf eine andere Weise. Da die Kolonien zur Nährlösung hin offen sind, lösen sich die abgerundeten Zellen ab und bilden Aggregate mit anderen Zellen des Überstandes. Diese Zellen exprimieren keine der getesteten keimzellspezifischen Gene und daher handelt es sich voraussichtlich um somatische Zellen, die sich an die Keimzelle(n) heften. Es ist jedoch nicht sicher, ob es sich um Vorläufer für Granulosazellen handelt. Dies wäre erstaunlich, weil sie sich gleichzeitig in der Schale entwickeln, loslösen und im Überstand an die Keimzellen heften müssten. Ebenfalls denkbar ist, dass es sich um Vorläufer für andere Zelltypen handelt, die sich durch die Oogonie in Granulosazellen differenzieren lassen. Aus dem Überstand einer Schale bilden sich eine Vielzahl von Aggregaten, aus denen sich follikelähnliche Strukturen entwickeln.

Diese Strukturen exprimieren die für deren Reifung notwendigen Gene und bringen schließlich Zellen hervor, die große Ähnlichkeit mit Eizellen besitzen. Bei längerer Kultur teilen sich die Eizellen in den follikelähnlichen Strukturen und entwickeln sich letztlich zu Gebilden, die nicht nur wie Blastozysten aussehen, sondern auch die entsprechenden molekularen Marker exprimieren.
Die Eizellen stellen die Basis für eine Reihe von weiteren Untersuchungen dar. Insbesondere sind die Wissenschaftler um Hans Schöler daran interessiert, ob sie in der Lage sind, einen somatischen Zellkern so zu programmieren, dass sich nicht nur Blastozysten bilden, sondern von ihnen auch ES-Zellen abgeleitet werden können. Durch den Transfer des gesamten Keimbahnzyklus in die Kulturschale hätten die Wissenschaftler nicht nur ein ideales System, um entwicklungs-, zell- und molekularbiologische Fragen stellen zu können, sondern möglicherweise auch die Grundlage für eine neue Art der regenerativen Medizin geschaffen.


