Koordination des Wachstums und der Funktionalität von Gehirngefäßen
Forschungsbericht (importiert) 2017 - Max-Planck-Institut für molekulare Biomedizin
Die Blut-Hirn-Schranke
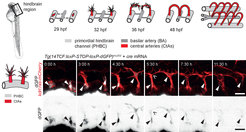
Abb. 1: Die Gehirnkapillaren (CtAs) wachsen aus parallel liegenden Gefäßen (PHBC) aus und verbinden sich dann miteinander oder mit der mittigen Arterie (BA) über Zell-Zell-Kontakte zu lumenisierten Gefäßen. Neue Erkenntnisse zeigen, dass der Wnt-Signalweg nicht nur vor dem Auswachsen, sondern während des ganzen Prozesses aktiv ist und sicherstellt, dass das Gefäßwachstum abgeschlossen ist, bevor der S1p-Signalweg die Schließung der Blut-Hirn-Schranke reguliert.
Blutgefäße bilden ein komplexes Transport-Netzwerk, durch welches das Blut in der Lage ist, alle Zellen des Körpers mit Sauerstoff, Nährstoffen und Signalmolekülen zu versorgen. Ähnlich wie in einem Straßennetz gibt es verschiedene Blutgefäße, die sich in ihren Aufgaben und daher auch ihren Strukturelementen unterscheiden. Allen Gefäßen gemeinsam ist aber, dass ihre innerste Zellschicht aus Endothelzellen besteht. Während manche Gefäße wie Autobahnen auf den schnellen Transport spezialisiert sind, sind andere so klein und dünn, dass sie den Gas- und Stoffaustausch mit den Körperzellen ermöglichen. Je nach Organ können die Endothelzellen dieser winzigen Kapillargefäße weitere Spezialisierungen aufweisen, die ihre Funktion unterstützen. Um das Gehirn besonders vor Krankheitserregern oder Giftstoffen zu schützen, bilden die dort befindlichen Kapillarendothelzellen eine zusätzliche Barriere aus, die sogenannte Blut-Hirn-Schranke. Zum einen begrenzen die Gehirnendothelzellen die Durchlässigkeit für im Blut befindliche Substanzen, Krankheitserreger und für Zellen des Immunsystems, indem sie zusätzliche Zell-Zellkontakte ausbilden; zum anderen besitzen sie besondere Transportmoleküle, um die Gehirnzellen mit lebenswichtigen Stoffen, wie Glukose, zu versorgen.
Neue Erkenntnisse zur Koordination der Blutgefäß-Entwicklung und Ausbildung der Blut-Hirn-Schranke
Im Rahmen einer gemeinsamen DFG-geförderten Forschungsinitiative zu Neurovaskulären Interaktionen beschäftigen wir uns mit der Frage, welche Signalwege im Gehirn die Blutgefäßentwicklung und ihre Spezialisierung steuern. Hierfür untersuchen wir die Blutgefäßentwicklung im lebenden Zebrafisch-Embryo mittels konfokaler Mikroskopie. Da die Fischembryonen durchsichtig sind, können in den Gehirnendothelzellen über genetisch gesteuerte GFP-Expression sogar subzelluläre Strukturen, wie z. B. die Aktin- Polymerisierung, genau beobachtet werden. Kathleen Hübner zeigte im Rahmen ihrer mit dem MTZ®-MPI-Award ausgezeichneten Doktorarbeit, dass der Wnt-Signalweg für die Endothelzellentwicklung im Gehirn zu mehreren Zeitpunkten aktiv ist und jeweils unterschiedliche Funktionen übernimmt. So steuern Wnt-Signale, welche Endothelzellen die Kapillargefäße bilden werden [1, 2], doch im weiteren Verlauf regulieren sie andere Signalwege, damit sich die Endothelzellen untereinander zu funktionalen lumenisierten Gefäßen verbinden (Abb. 1). Diese bisher unbekannte Funktion des Wnt-Signalweges basiert auf der Blockade der Sphingosin-1-Phosphat-induzierten Signalweiterleitung [3]. Da Sphingosin-1-Phosphat im späteren Verlauf wesentlich zur Ausbildung der Blut-Hirn-Schranke benötigt wird, reguliert der Wnt-Signalweg somit das Umschalten zwischen Gefäßwachstum und Schrankenausbildung.
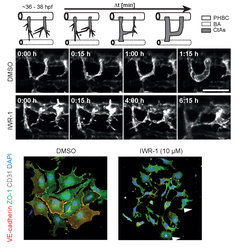
In Zusammenarbeit mit Forschern der Abteilung „Gewebebiologie und Morphogenese“ von Prof. Adams konnte Kathleen Hübner zeigen, dass diese unbekannte Funktion des Wnt-Signalweges auch in primären Maus-Gehirn-Kapillarzellen konserviert ist (Abb. 2), so dass unsere Erkenntnisse vom Fisch auf Säugetiere übertragen werden können. Bereits heute sind Medikamente in Entwicklung, die entweder in den einen oder den anderen Signalweg eingreifen. Insofern wird ein besseres Verständnis der Wirkungsweisen und Interaktionen dieser Signalprozesse auch zu zielgerichteteren Therapieansätzen führen können.
Ausblick
Unsere Erkenntnisse zeigen, dass nicht nur die Funktion einzelner Signalwege die Entwicklung und Spezialisierung der Blutgefäße steuern, sondern dass auch der genaue Zeitpunkt der Signalweiterleitung und die Interaktionen verschiedener Signalwege wesentliche Bestandteile dieser Regulation sind. Gerade in pathologischen Situationen könnte die Balance zwischen Gefäßneubildung und Dichte der Blut-Hirn-Schranke eine wichtige Rolle spielen. Unser Team analysiert nun den genauen Mechanismus der Signalweginteraktionen, beschäftigt sich aber auch mit der Frage, warum die gleichen Endothelzellen während des Wachstums auf Wnt-Signale reagieren, aber im weiteren Verlauf nicht, beziehungsweise wie die Ausbildung der Blut-Hirn-Schranke gesteuert wird. Langfristig sollen die Signalwechselwirkungen in verschiedenen Schlaganfallmodellen untersucht werden.

